近日,由浙江中医药大学附属第三医院方剑乔教授、刘伯一研究员领衔的科研团队在慢性痛及针刺镇痛机制研究取得重要进展,于Science子刊—Science Advances(中科院大类一区,Top期刊)发表了题为“Neuronal Reg3β/macrophage TNF-α-mediated positive feedback signaling contributes to pain chronicity in a rat model of CRPS-I”的研究论文。

I型复杂性区域疼痛综合征(CRPS-I), 是一种病因不明、机制复杂的慢性疼痛综合征,通常由肢体损伤或组织缺血等诱发。其临床症状主要为肢端疼痛及血管舒缩异常,可导致肢体功能障碍,严重影响患者生活质量。诱发CRPS-I的初始创伤往往几周之内便可消褪,但却往往引发患者出现长达半年以上慢性痛。目前人们对CRPS-I疼痛慢性化发生机制并不十分清楚,极大限制了临床治疗策略的研发。 CRPS-I在中医可被归为“痹症”范畴,是由正气不足,邪气趁虚而入,导致气血凝滞,痹阻经络所导致。方剑乔教授认为痹症之本在于正气亏虚,而标则体现为疼痛、活动障碍等经脉阻滞症状,并主张“虚瘀交错,必先化瘀,结合补虚,方能止痛”的针灸治疗原则。在方剑乔教授电针镇痛临床经验指导下,刘伯一研究员带领团队发现电针“足三里”和“昆仑”穴可有效提升模型动物血流灌注,改善血瘀,缓解疼痛。团队进一步发现背根感觉神经节(DRG)Reg3β基因(Reg3b)是对电针干预出现显著响应的基因(Front Neurol,2020),提示Reg3β可能是导致慢性痛发生的关键物质及电针干预潜在靶点。 在此基础上,团队对模型动物DRG进行单细胞测序,发现DRG内巨噬细胞浸润在慢性痛全过程中均出现增多,且剔除巨噬细胞能有效缓解疼痛,提示巨噬细胞持续浸润是导致慢性痛的关键机制。通过病毒示踪和细胞特异性敲低等实验,团队发现当施加伤害性刺激后, Reg3β可由DRG神经元合成和释放,并从DRG神经节内血管趋化单核/巨噬细胞,导致DRG内巨噬细胞浸润。DRG内巨噬细胞浸润后发生M1极化,释放炎症因子TNF-α。团队发现由巨噬细胞释放的TNF-α可增强DRG神经元TRPV1通道功能活性,引发伤害性感觉神经元兴奋性增强,导致外周敏化,引发慢性痛。团队还发现,若阻断TNF-α通路,可进而抑制DRG神经元合成和释放Reg3β。团队进一步发现TNF-α诱导DRG神经元合成和分泌Reg3β的生物过程是由神经元TNFR1-Syk-STAT3信号轴介导。
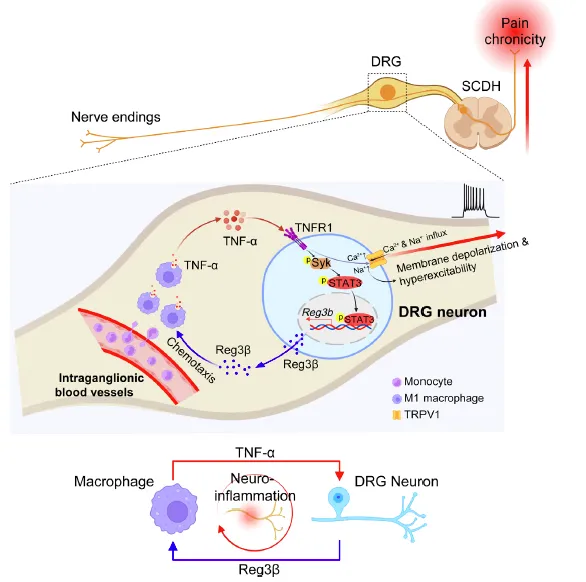
该研究系统阐明了在CRPS-I发生后,感觉神经节内存在一条Reg3β/TNF-α正反馈促炎通路,该通路可引发神经元—巨噬细胞间对话,导致感觉神经节内神经炎症持续发生和外周敏化,造成慢性痛。研究揭示了CRPS-I慢性痛发生的关键机制,也为电针干预慢性痛机制研究提供了崭新方向。团队目前正围绕电针对该促炎通路的干预开展下一步研究,以期推动电针用于CRPS-I临床治疗。 浙江中医药大学第三临床医学院聂慧敏、刘伯宇、尹诚语及河北医科大学董紫姗为本论文共同第一作者。河北大学王川教授,浙江中医药大学方剑乔教授和刘伯一研究员为本论文共同通讯作者。本研究得到了北京友谊医院田贵华主任医师和浙江中医药大学邵晓梅研究员的大力支持。本研究受到国家自然科学基金面上项目、浙江省自然科学基金重点项目及北京中医药大学东直门医院临床研究和成果转化能力提升试点项目等资助。浙江省针灸神经病学研究重点实验室为本研究开展提供了平台保障。 由方剑乔教授领衔的针灸科研团队长期致力于针刺镇痛基础及临床研究。近年来,在国家重点研发计划“中医药现代化”重点专项、国家自然科学基金区域创新发展联合基金等支持下,团队重点围绕慢性痛及针刺干预慢性痛神经免疫及环路机制开展研究并取得一系列重要成果(Sci Adv, 2025; Nat Commun, 2024; Theranostics, 2020, 2024a&2024b; Neuropsychopharmacology, 2025, J Neuroinflammation, 2020, 2021a&2021b, 2023; Cell Rep, 2021; CNS Neurosci Ther, 2023&2024; JCI Insight 2019; Proc Natl Acad Sci U S A, 2016)。相关成果获高等学校科学研究优秀成果二等奖、中国针灸学会科学技术一等奖等。 原文链接:Nie H, Liu B, Yin C, Dong Z, Pan Y, Li P, Hu Q, Wang J, Tai Y, Shao X, Tian G, Wang C, Fang J, Liu B. Neuronal Reg3β/macrophage TNF-α-mediated positive feedback signaling contributes to pain chronicity in a rat model of CRPS-I. Sci Adv. 2025 Aug;11(31):eadu4270. doi: 10.1126/sciadv.adu4270.